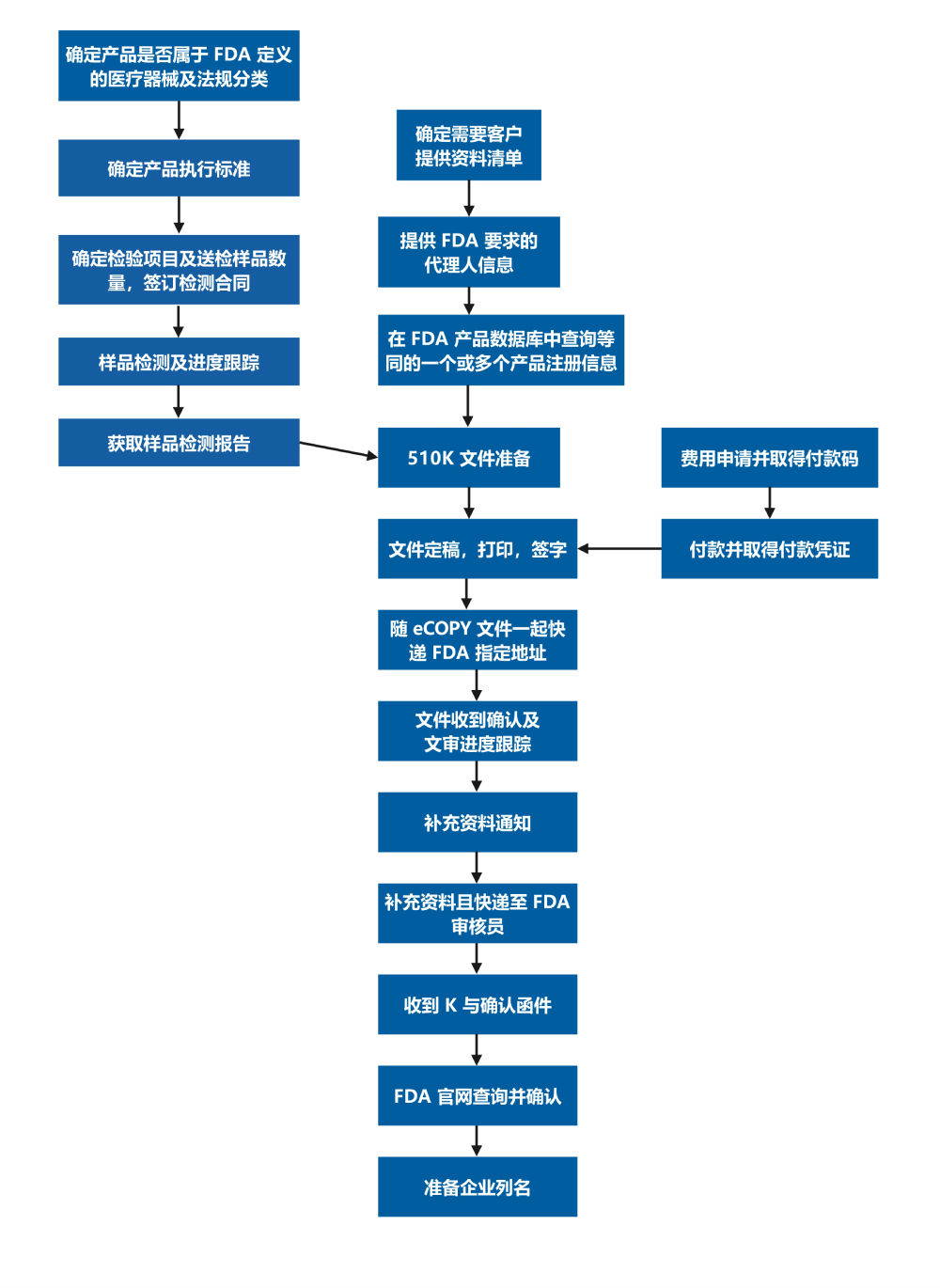
为了在美国上市医疗器械,制造商必须经过两个评估过程其中之一:上市前通知书[510(k)](如果没有被510(k)赦免),或者上市前批准(PMA)。 大多数在美国进行商业分销的医疗器械都是通过上市前通知书[510(k)]的形式得到批准的。在某些情况下,在1976年5月28日之前合法上市的器械,既不要求递交510(k)也不要求递交PMA。
510(k)文件是向FDA递交的上市前申请文件,目的是证明申请上市的器械与不受上市前批准(PMA)影响的合法上市器械同样安全有效,即为等价器械(substantially equivalent)。申请者必须把申请上市的器械与现在美国市场上一种或多种相似器械对比,得出并且支持等价器械的结论。合法上市器械是在1976年5月28日之前合法上市的器械(preamendment device),或者从III类器械中分入II或I类的器械,或者通过510(k)程序发现与这样的器械等价的器械,或者通过自动的III 类器械定义的评价建立的器械。与之等价的器械被称为“predicate device(s)”。 申请者必须提交描述性的数据,必要的时候,要提交性能数据来说明器械是predicate device的等价器械。
目前递交510K文件有三种类型
即:
510(k)上市前通告申请有3种类型
传统510(k)是21 CFR 807中规定的原始、完整的申请。特殊510(k)和简化510(k)申请作为备选申请途径。FDA指南文件《新的510(k)格式-上市前通告证明实质性等同的替代途径-最终指南(1998年3月)》清楚地描述了在适当的情况下可用于证明实质性等同的两种替代途径,可以供不清楚如何递交510K文件的人员参考。
办理流程: