欧洲议会和理事会于2017年4月5日签发的关于医疗器械第2017/745号法规,并废除了理事会第90/385/EEC号和第93/42/EEC号指令;欧洲议会和理事会于2017年4月5日签发的关于体外诊断医疗器械第2017/746号(EU)法规并废除了第98/79/EC号指令,两大法规于2017年5月5日在欧盟官方公布,并于公布后的三年开始正式实施。与原来的三个指南性文件相比,有以下内容的变化:
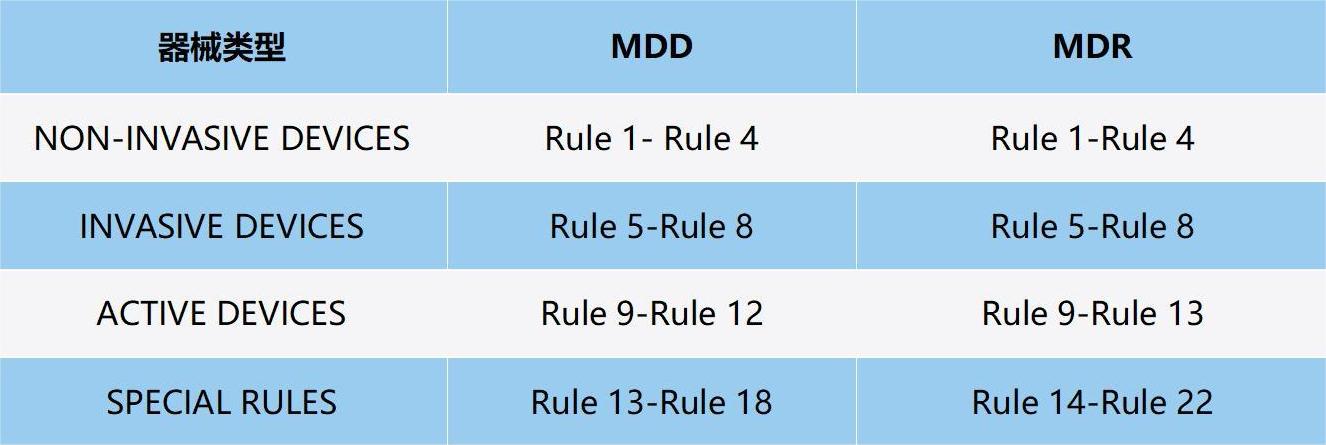
Rule1-Rule 4:NON-INVASIVE DEVICES非侵入性器械
Rule 3:增加了用于体外直接从人体或人类胚胎取下体外使用的人体细胞、组织、气管,然后再植入或注入体内,此类器械为III类。
Rule 5-Rule 8:INVASIVE DEVICES侵入性器械。
Rule 8:在原来的基础上添加了:有源植入器械或其相关附件,乳房植入物或心脏修补网状织物,完整或部分关节置换物,直接与脊柱接触的椎间盘置换植入物为III类。
Rule 9-Rule 13:ACTIVE DEVICES有源器械
Rule 9:在原来的基础上增加了“针对治疗目的释放电离辐射的有源器械”以及“用于控制、监测或直接影响有源植入式器械”,这两大类器械均为II b类。
Rule 11:新添加,提出用于提供诊断或治疗目的决策信息和监测生理过程的软件,均为II a类;其他软件类为I类。
Rule 14-Rule 22:SPECIAL RULES特殊规则。
Rule 14:进一步完善了“衍生自人体血液或血浆的医疗产品”分类的要求。
Rule 18:进一步完善“利用非活性或处理为非活性的人体或动物源组织或细胞或其他衍生物制成的器械”的分类要求。
Rule 19:添加对纳米材料器械的分类要求。
Rule 20:添加了通过吸入方式,与身体孔口相关的侵入器械的分类。
Rule 21:添加了引入人体可吸收物质到人体的器械。
Rule 22:添加了具有集成或合并诊断功能的有源治疗器械的分类。